Julius Robert Oppenheimer
(Nueva York, 1904 - Princeton, Estados Unidos, 1967) Físico estadounidense que dirigió el desarrollo de la bomba atómica en el laboratorio de Los Álamos (Nuevo México), en el marco del llamado Proyecto Manhattan. Hijo de un inmigrante alemán que se enriqueció con la importación de productos textiles, J. Robert Oppenheimer se graduó en la Universidad de Harvard en 1925. Luego se trasladó al Reino Unido para investigar en el Cavendish Laboratory, dirigido por Ernest Rutherford.
-----
Ernest Rutherford
(Nelson, Nueva Zelanda, 1871 - Londres, 1937) Físico y químico británico. Tras licenciarse, en 1893, en Christchurch (Nueva Zelanda), Ernest Rutherford se trasladó a la Universidad de Cambridge (1895) para trabajar como ayudante de Joseph John Thomson. En 1898 fue nombrado catedrático de la Universidad McGill de Montreal, en Canadá. A su regreso al Reino Unido (1907) se incorporó a la docencia en la Universidad de Manchester, y en 1919 sucedió al propio Thomson como director del Cavendish Laboratory de la Universidad de Cambridge.
Por sus trabajos en el campo de la física atómica, Ernest Rutherford está considerado como uno de los padres de esta disciplina. Investigó sobre la detección de las radiaciones electromagnéticas y sobre la ionización del aire producida por los rayos X, estudió las emisiones radioactivas descubiertas por Henri Becquerel, y logró clasificarlas en rayos alfa, beta y gamma. En 1902, en colaboración con Frederick Soddy, Rutherford formuló la teoría sobre la radioactividad natural asociada a las transformaciones espontáneas de los elementos. Colaboró con Hans Geiger en el desarrollo del contador de radiaciones conocido como contador Geiger, y en 1908 demostró que las partículas alfa son iones de helio (más exactamente, núcleos del átomo de helio).
En 1911 describió un nuevo modelo atómico (modelo atómico de Rutherford), que posteriormente sería perfeccionado por Niels Bohr. Según este modelo, existía en el átomo un núcleo central en el que se concentraba la casi totalidad de la masa, así como las cargas eléctricas positivas, y una envoltura o corteza de electrones (carga eléctrica negativa). Logró demostrar experimentalmente dicha teoría a partir de las desviaciones que se producían en la trayectoria de las partículas emitidas por sustancias radioactivas cuando con ellas se bombardeaban los átomos. Los experimentos llevados a cabo por Rutherford permitieron, además, el establecimiento de un orden de magnitud para las dimensiones reales del núcleo atómico.
Durante la Primera Guerra Mundial estudió la detección de submarinos mediante ondas sonoras, de modo que fue uno de los precursores del sonar. Finalizada la contienda, en 1919 logró la primera transmutación artificial de elementos químicos mediante el bombardeo de un átomo de nitrógeno con partículas alfa; las transmutaciones se deben a la capacidad de transformarse que tiene un átomo sometido a bombardeo con partículas capaces de penetrar en su núcleo.
Muy poco después de su descubrimiento se precisaron las características de las transmutaciones y se comprobó que la energía cinética de los protones emitidos en el proceso podía ser mayor que la de las partículas incidentes, de modo que la energía interna del núcleo tenía que intervenir la transmutación. En 1923, tras fotografiar cerca de 400.000 trayectorias de partículas con la ayuda de una cámara de burbujas (cámara de Wilson), Patrick Blackett pudo describir ocho transmutaciones y establecer la reacción que había tenido lugar.
Rutherford recibió el Premio Nobel de Química de 1908 en reconocimiento a sus investigaciones relativas a la desintegración de los elementos. Entre otras distinciones, fue elegido miembro (1903) y presidente (1925-1930) de la Royal Society de Londres, y se le concedieron los títulos de sir (1914) y de barón Rutherford of Nelson (1931); el elemento 104 de la tabla periódica se denomina Rutherfordio en su honor. A su muerte, sus restos mortales fueron inhumados en la abadía de Westminster.
----------
https://youtu.be/2pMEFI23lDU
Invitado por Max Born a la Universidad de Gotinga, por la que se doctoró en 1927, conoció allí a otros físicos eminentes, como Niels Bohr o Paul Dirac. Tras una corta visita a las universidades de Leiden y Zurich, Oppenheimer regresó a Estados Unidos para impartir clases de física en la Universidad de Berkeley y en el California Institute of Technology.
En un principio centró su atención en los procesos energéticos de las partículas subatómicas, incluidos los electrones, positrones y rayos cósmicos. Pronto se involucró en asuntos políticos, preocupado por el auge del nazismo en Alemania. En 1936 se mostró partidario del bando republicano tras el estallido de la guerra civil española.
Al heredar la fortuna de su padre, fallecido en 1937, no desaprovechó ninguna oportunidad de subvencionar diversas organizaciones antifascistas. Decepcionado por el comportamiento dispensado a los científicos rusos por la dictadura de Stalin, terminó por desligarse de las asociaciones comunistas a las que estuvo vinculado.

Einstein y Oppenheimer
Ante el estallido de la Segunda Guerra Mundial, sus colegas Albert Einstein y Leo Szilard advirtieron acerca de la terrible amenaza que suponía para la humanidad la posibilidad de que el régimen de Hitler fuera el primero en disponer de una bomba atómica. Oppenheimer empezó entonces a investigar tenazmente sobre el proceso de obtención de uranio-235 a partir de mineral de uranio natural, a la vez que determinaba la masa crítica de uranio requerida para la puesta a punto de la bomba.
En 1942 se integró al Proyecto Manhattan, destinado a gestionar la investigación y el desarrollo por parte de científicos británicos y estadounidenses de la energía nuclear con fines militares. La sede central, el laboratorio secreto de Los Álamos, en Nuevo México, fue elegida por el propio Oppenheimer.
Tras el éxito de la prueba efectuada en Alamogordo en 1945, Robert Oppenheimer dimitió como director del proyecto. Dos años después fue elegido presidente de la Comisión para la Energía Atómica estadounidense, cargo que ejerció hasta 1952. Un año más tarde, debido a su antigua vinculación con los comunistas, fue víctima de la «caza de brujas» del senador Joseph McCarthy y se le destituyó de la presidencia de la Comisión. Los últimos años de su vida los dedicó a la reflexión sobre los problemas surgidos de la relación entre la ciencia y la sociedad.
Cómo citar este artículo:
Fernández, Tomás y Tamaro, Elena. «Biografia de Julius Robert Oppenheimer». En Biografías y Vidas. La enciclopedia biográfica en línea [Internet]. Barcelona, España, 2004. Disponible en https://www.biografiasyvidas.com/biografia/o/oppenheimer.htm [fecha de acceso: 1 de febrero de 2023].
Max Born
(Breslau, 1882 - Göttingen, 1970) Físico alemán de origen judío, uno de los más eminentes del siglo XX, que recibió el premio Nobel de Física en 1954. Formado en la Universidad de Göttingen, que contaba entonces con matemáticos tan prestigiosos como Felix Klein, David Hilbert y Hermann Minkowski, Max Born enseñó física teórica en la Universidad de Berlín, donde se relacionó con Einstein y Fritz Haber. En 1919 se trasladó a la Universidad de Frankfurt y, en 1929, a la de Göttingen. Gracias a él, esta última institución se convertiría en la escuela de física teórica más importante del mundo.

Max Born
Llevó a cabo importantes investigaciones sobre dinámica de las estructuras reticulares cristalinas (Dynamik der Kristallgitter, 1915) y acerca de la teoría de la relatividad (Die Relativitätstheorie, 1923), y estableció una esencial clarificación crítica de la mecánica cuántica (Atommechanik, 1925; Atomdynamik, 1926 y Física atomica, 1935). En 1933, con el ascenso al poder del nazismo, Max Born fue desposeído de la cátedra por su condición de judío. Emigró entonces al Reino Unido, adoptó la nacionalidad británica y ejerció la docencia en Cambridge y, desde 1936 hasta 1953, en Edimburgo.
A continuación regresó a Göttingen, y en 1954 le fue otorgado el premio Nobel de Física, que compartió con Walther Bothe. En 1943 había formulado, en colaboración con V. Peng, una teoría cuántica del campo electromagnético en la que se introducía una nueva elaboración estadística de los cuantos de luz. Entre sus obras cabe señalar The Restless Universe (1936), Dynamical Theory of Cristal Lattices (1953, en colaboración con Kun Huang), Physik im Wandel meiner Zeit (1957) y Physik und Politik (1960). Sus memorias se publicaron póstumamente: My Life. Recollection of a Nobel Laureate (1978).
-----------
VIERNES 3 FEBRERO 2023 - 19.57
Niels Bohr
(Niels Henrik David Bohr; Copenhague, 1885 - 1962) Físico danés. Considerado como una de las figuras más deslumbrantes de la física contemporánea y, por sus aportaciones teóricas y sus trabajos prácticos, como uno de los padres de la bomba atómica, fue galardonado en 1922 con el Premio Nobel de Física "por su investigación acerca de la estructura de los átomos y la radiación que emana de ellos".

Niels Bohr
Pese a contravenir principios de la física clásica, su modelo atómico, que incorporaba el modelo de átomo planetario de Rutherford y la noción de cuanto de acción introducida por Planck, permitió explicar tanto la estabilidad del átomo como sus propiedades de emisión y de absorción de radiación. En esta teoría, el electrón puede ocupar algunas órbitas estacionarias en las cuales no irradia energía, y los procesos de emisión y de absorción son concebidos como transiciones del electrón de una órbita estacionaria a otra.
Biografía
Niels Bohr cursó estudios superiores de física en la Universidad de Copenhague, donde obtuvo el grado de doctor en 1911. Tras haberse revelado como una firme promesa en el campo de la física nuclear, pasó a Inglaterra para ampliar sus conocimientos en el prestigioso Cavendish Laboratory de la Universidad de Cambridge, bajo la tutela de sir Joseph John Thomson (1856-1940),
Joseph John Thomson
(Cheetham Hill, Reino Unido, 1856 - Cambridge, id., 1940) Físico británico. Hijo de un librero, Joseph John Thomson estudió en el Owens College y más tarde en la Universidad de Manchester y en el Trinity College de Cambridge. Se graduó en matemáticas en 1880, ocupó la cátedra Cavendish y, posteriormente, fue nombrado director del Laboratorio Cavendish de la Universidad de Cambridge.

Joseph John Thomson
Thomson investigó la naturaleza de los rayos catódicos y demostró que los campos eléctricos podían provocar la desviación de éstos. Llevó a cabo numerosos experimentos sobre su desviación, bajo el efecto combinado de campos eléctricos y magnéticos, buscando la relación existente entre la carga y la masa de la partículas, proporcionalidad que se mantenía constante aun cuando se alterase el material del cátodo.
En 1897 descubrió una nueva partícula y demostró que era aproximadamente mil veces más ligera que el hidrógeno. Esta partícula sería bautizada con el nombre de electrón, designación propuesta años antes por el irlandés George Johnstone Stoney,
George Johnstone Stoney
(Oakley Park, 1826 - Londres, 1911) Físico y matemático irlandés. Se formó en el Trinity College de la capital irlandesa y ejerció la docencia en la Queen's University, de la que fue también secretario. Estudioso de la estructura de la materia, se dedicó a realizar una primera evaluación del número de Avogadro.

George Johnstone Stoney
En 1874 estableció la hipótesis según la cual la electricidad era creada por unos corpúsculos elementales que llamó electrones, cuya carga intentó calcular. Años después, en 1897, la intuición de George Johnstone Stoney sobre la naturaleza de la electricidad fue confirmada por el físico inglés Joseph John Thomson, que demostró que el flujo de la corriente eléctrica consistía en corpúsculos individuales (a los que acabaría por llamarse electrones en honor a Stoney), todos ellos con la misma relación de carga eléctrica con respecto a la masa (e/m).
Cómo citar este artículo:
que había teorizado sobre su existencia. Joseph John Thomson fue, por lo tanto, el primero que identificó partículas subatómicas, y llegó a importantes conclusiones sobre estas partículas cargadas negativamente: con el aparato que construyó obtuvo la relación entre la carga eléctrica y la masa del electrón.
Thomson examinó además los rayos positivos, estudiados anteriormente por Eugen Goldstein, y en 1912 descubrió el modo de utilizarlos en la separación de átomos de diferente masa. El objetivo se consiguió desviando los rayos positivos en campos eléctricos y magnéticos, método que en la actualidad se llama espectrometría de masas. Con esta técnica descubrió que el neón posee dos isótopos, el neón-20 y el neón-22.
Eugen Goldstein
(Gleiwitz, 1850 - Berlín, 1930) Físico alemán. Colaborador del Observatorio de Berlín y del Instituto de Física Técnica, fue el descubridor de los rayos positivos o canales e introdujo el término «rayos catódicos».
Rayo anódico
Los rayos catódicos son corrientes de electrones en tubos de vacío, es decir en los tubos de cristal que se equipan por lo menos con dos electrodos, un cátodo y un ánodo en una configuración conocida como Diodo. Cuando se calienta el cátodo, emite una cierta radiación que viaja hacia el ánodo. Wikipedia
Estudió también los espectros atómicos.
Eugen Goldstein
Profesor de física en la Universidad de Berlín desde 1888, Eugen Goldstein llevó a cabo, con la ayuda de la Academia alemana de Ciencias, numerosos experimentos sobre las descargas eléctricas en el vacío que le llevaron al descubrimiento de los rayos canales. El estudio de las trayectorias de tales rayos conduciría en 1913 a Joseph John Thomson y Francis Aston al descubrimiento de los isótopos.
--------
Francis William Aston
(Birmingham, 1877 - Londres, 1945) Físico y químico inglés. Formado en las universidades de Birmingham y Cambridge, fue colaborador del laboratorio Cavendish, al que acudió invitado por Joseph John Thomson. En 1919 inventó el espectrógrafo de masas, por el que obtendría el premio Nobel de Química de 1922. El espectrógrafo de masas es un dispositivo experimental que permite separar las partículas cargadas en función de su masa. Descubrió así la existencia de un total de 212 isótopos antes desconocidos y la regla que lleva su nombre, que afirma que los elementos atómicos de número impar no pueden tener más de dos isótopos estables.

Francis William Aston
La espectrometría de masas se fundamenta en un principio simple: cuando un flujo de partículas cargadas se somete a la acción de un campo magnético, experimenta una desviación; la amplitud de dicha desviación depende de la masa y de la carga de las partículas que integran el flujo. El espectrómetro o espectrógrafo de masas consta, esencialmente, de tres partes: la cámara de ionización, la cámara de desviación y el detector. En la cámara de ionización, los átomos de la sustancia que se pretende identificar reciben una energía de excitación que les hace perder electrones. A veces dicha energía se consigue simplemente calentando la muestra. Como consecuencia de la pérdida de electrones, los átomos se convierten en partículas cargadas positivamente que reciben el nombre de iones.
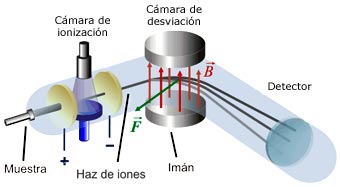
Los iones producidos en la cámara de ionización pasan luego a la cámara de desviación. La cámara de desviación está sometida a un campo magnético intenso. Cuando el flujo de iones positivos atraviesa la cámara, la trayectoria de cada uno de ellos experimenta una desviación por efecto del campo magnético; en lugar de atravesar la cámara en línea recta, lo hacen siguiendo una curva. El grado de curvatura de cada trayectoria depende de la masa y la carga del ion positivo; los iones pesados siguen una trayectoria que no se aparta mucho de la línea recta, mientras que los más ligeros resultan más desviados.
Al salir de la cámara de desviación, los iones positivos chocan con una placa fotográfica, o un elemento similar, instalada en el detector. El detector registra la magnitud de las desviaciones con respecto a la línea recta experimentadas por las trayectorias de las partículas que integran la muestra, indicando así la masa y la carga de dichas partículas. Dado que cada elemento y cada átomo poseen una masa y una carga características, la lectura del registro recogido por el detector permite identificar los átomos presentes en la muestra.

Francis William Aston con su espectrógrafo de masas
Ya en el curso de su primera investigación con el espectrógrafo de masas, Francis William Aston realizó un notable descubrimiento: al hacer pasar por el aparato una muestra de gas neón puro, advirtió que en el detector se formaban dos manchas separadas, lo cual significaba que el gas contenía átomos correspondientes a dos masas diferentes.
Aston interpretó que su descubrimiento señalaba la existencia de dos tipos diferentes de átomos de neón. Ambos debían poseer el mismo número de protones, puesto que todas las formas de neón contienen siempre el mismo número de protones, pero un número diferente de neutrones y, en consecuencia, sus masas atómicas debían ser diferentes. Los trabajos de Aston proporcionaron así la primera prueba experimental de la existencia de isótopos, es decir, de formas de un mismo átomo con un número igual de protones pero con un número diferente de neutrones. El científico británico describió sus descubrimientos en obras como Los isótopos (1922) y Espectros de masa e isótopos (1933).
Al permitir determinar las masas de las partículas que forman parte de una muestra, con el objeto de identificarlas, la espectrometría de masas ha tenido y tiene aplicaciones innumerables. Actualmente, por ejemplo, se emplea para identificar los vestigios de sustancias hallados en lugares donde se ha cometido un delito, cuando las cantidades encontradas son demasiado pequeñas para ser identificadas de otra manera.
Cómo citar este artículo:
----------
Goldstein hizo la primera comunicación de su descubrimiento a la Academia de Berlín en 1886 y prosiguió sus investigaciones sobre el mismo tema hasta aproximadamente 1915. En 1930 sus estudios, que se encontraban diseminados en publicaciones alemanas, fueron reunidos y publicados por Gehrcke con el título de Rayos Canales.
Goldstein observó que, al producirse una descarga eléctrica en un tubo que contuviera un gas rarificado, empleando como electrodo negativo (cátodo) una lámina metálica normal al eje del tubo y provista de unos agujeritos, se veían partir de los propios agujeros brillantes rayas rectilíneas dirigidas a la parte opuesta a la ocupada por el electrodo positivo (ánodo). Si el gas contenido en el tubo era aire, las rayas presentaban un hermoso color amarillo. La forma rectilínea hizo en seguida pensar en rayos que se propagasen en línea recta. Goldstein dio entonces a estas rayas el nombre de rayos canales, queriendo con ello significar que salían de los canales practicados en el cátodo.
Este curioso nombre (que debía ser provisional, en espera de que se revelase la naturaleza del fenómeno) se impuso en el uso y ha pasado al vocabulario científico internacional. Del hecho de que dos haces de rayos canales puedan cruzarse sin estorbarse, y del hecho de que no parecían influenciables por medio de campos eléctricos ni magnéticos, Goldstein excluyó que se pudiese tratar de partículas de materia cargadas de electricidad y lanzadas a grandes velocidades. Pero luego se demostró que tal punto de vista era equivocado, y hoy se sabe que los rayos están constituidos de partículas cuyo peso es del orden del átomo y que, formados en las proximidades del cátodo, atraviesan los agujeritos a velocidades altísimas, y continúan propagándose en línea recta por inercia.
Eugen Goldstein desarrolló todas las variaciones posibles sobre el tema de los rayos canales, experimentando con cátodos de las más variadas formas y disposiciones. Es notable la fantasía que demostró en este aspecto del trabajo, y resultó ser precioso el material experimental recogido por él, pues contribuyó no poco a la solución del problema de los rayos canales.
El descubrimiento de estos rayos, que ya fue debidamente apreciado en su tiempo, constituyó después una de las piedras fundamentales para la construcción de la física contemporánea. En efecto, gracias a los rayos canales se dispuso por primera vez de enjambres de átomos en movimiento rápido y ordenado, cuya aplicación resultaría fecundísima en varias ramas de la física atómica, como, por ejemplo, en el estudio de los isótopos.
Todos estos trabajos sirvieron a Thomson para establecer un nuevo modelo de la estructura del átomo que resultó incorrecto, pues suponía que las partículas cargadas positivamente se encontraban mezcladas homogéneamente con las negativas.
Thomson recibió el premio Nobel de Física en 1906 por sus estudios acerca del paso de la electricidad a través del interior de los gases. Calculó la cantidad de electricidad transportada por cada átomo y determinó el número de moléculas por centímetro cúbico. Escribió varias obras, entre las que destacan The Discarge of Electricity Through Gases, Conduction of Electricity Through Gases, The Corpuscular Theory of Matter, The Electron in Chemistry y Recollections and Reflections. En 1937, su hijo George Paget Thomson obtuvo también el premio Nobel de Física por el descubrimiento de la difracción de los electrones.
Cómo citar este artículo:
químico británico distinguido con el Premio Nobel en 1906 por sus estudios acerca del paso de la electricidad a través del interior de los gases, que le habían permitido descubrir el electrón, partícula anteriormente intuida y bautizada por George Johnstone Stoney (1826-1911).
Precisamente al estudio de los electrones estaba dedicada la tesis doctoral que acababa de leer el joven Bohr en Copenhague, y que había llevado a territorio británico con la esperanza de verla traducida al inglés. Pero, comoquiera que Thomson no se mostrara entusiasmado por el trabajo del científico danés, Bohr decidió abandonar el Cavendish Laboratory y marcharse a la Universidad de Manchester, donde aprovechó las enseñanzas de otro Premio Nobel, Ernest Rutherford (1871-1937), para ampliar sus saberes sobre los modelos del átomo y la radiactividad, descubierta por Pierre y Marie Curie.
A partir de entonces, entre ambos científicos se estableció una estrecha colaboración que, sostenida por firmes lazos de amistad, habría de ser tan duradera como fecunda. Rutherford había elaborado una teoría del átomo que era totalmente válida en un plano especulativo, pero que no podía sostenerse dentro de las leyes de la física clásica. Bohr, en un alarde de audacia que resultaba impredecible en su carácter tímido y retraído, se atrevió a soslayar los problemas que obstaculizaban los progresos de Rutherford con una solución tan sencilla como arriesgada: afirmó, simplemente, que los movimientos que se daban dentro del átomo están gobernados por unas leyes ajenas a las de la física tradicional.

Niels Bohr en el laboratorio (1922)
En 1913, Niels Bohr alcanzó celebridad mundial dentro del ámbito de la física al publicar una serie de ensayos en los que revelaba su particular modelo de la estructura del átomo. Tres años después, el científico danés regresó a su ciudad natal para ocupar una plaza de profesor de Física Teórica en su antigua alma mater; y en 1920, merced al prestigio internacional que había ido adquiriendo por sus estudios y publicaciones, consiguió las subvenciones necesarias para la fundación del denominado Instituto Nórdico de Física Teórica (más tarde denominado Instituto Niels Bohr), cuya dirección asumió desde 1921 hasta la fecha de su muerte (1962).
En muy poco tiempo este instituto se erigió, junto a las universidades alemanas de Munich y Göttingen, en uno de los tres vértices del triángulo europeo donde se estaban desarrollando las principales investigaciones sobre la física del átomo. En 1922, año en el que Bohr se consagró definitivamente como científico de renombre universal con la obtención del Premio Nobel, vino al mundo su hijo Aage Bohr, que habría de seguir los pasos de su padre y colaborar con él en varias investigaciones. Doctorado también en física, fue, al igual que su progenitor, profesor universitario de dicha materia y director del Instituto Nórdico de Física Teórica, y recibiría el Premio Nobel en 1975.
Inmerso en sus investigaciones sobre el átomo y la mecánica cuántica, Niels Bohr enunció, en 1923, el principio de la correspondencia, al que añadió en 1928 el principio de la complementariedad. A raíz de esta última aportación se fue constituyendo en torno a su figura la denominada Escuela de Copenhague de la mecánica cuántica, cuyas teorías fueron combatidas ferozmente (y ciertamente en vano) por Albert Einstein (1879-1955). A pesar de estas diferencias, sostenidas siempre en un plano teórico (pues Einstein sólo pudo oponer a las propuestas de Bohr elucubraciones mentales), el padre de la teoría de la relatividad reconoció en el físico danés a "uno de los más grandes investigadores científicos de nuestro tiempo".
En la década de los años treinta, Niels Bohr pasó largas temporadas en los Estados Unidos de América, adonde llevó las primeras noticias sobre la fisión nuclear, descubierta en 1938 en Berlín por Otto Hahn (1879-1968) y Fritz Strassmann (1902-1980), que habrían de dar lugar a los trabajos de fabricación de armas nucleares de destrucción masiva. Durante cinco meses trabajó con J. A. Wheeler en el Instituto de Estudios Avanzados de Princeton (Nueva Jersey), y anunció, junto con su colaborador, que el plutonio había de ser fisionable, al igual que lo era el uranio.
De regreso a Dinamarca, fue elegido presidente de la Real Academia Danesa de Ciencias (1939). Volvió a instalarse en Copenhague, en donde continuó investigando e impartiendo clases hasta que en 1943, a raíz de la ocupación alemana, tuvo que abandonar su país natal debido a sus orígenes judíos. Su vida y la de los suyos llegaron a estar tan amenazadas que se vio forzado a embarcar a su familia en un pequeño bote de pesca y poner rumbo a Suecia. Pocos días después, Bohr se refugió en los Estados Unidos y, bajo el pseudónimo de Nicholas Baker, empezó a colaborar activamente en el denominado Proyecto Manhattan, desarrollado en un laboratorio de Los Álamos (Nuevo México), cuyo resultado fue la fabricación de la primera bomba atómica.
Al término de la II Guerra Mundial (1939-1945), retornó a Dinamarca y volvió a ponerse al frente del Instituto Nórdico de Física Teórica. A partir de entonces, consciente de las aplicaciones devastadoras que podían tener sus investigaciones, se dedicó a convencer a sus colegas de la necesidad de usar los hallazgos de la física nuclear con fines útiles y benéficos.
Pionero en la organización de simposios y conferencias internacionales sobre el uso pacífico de la energía atómica, en 1951 publicó y divulgó por todo el mundo un manifiesto firmado por más de un centenar de científicos eminentes, en el que se afirmaba que los poderes públicos debían garantizar el empleo de la energía atómica para fines pacíficos. Por todo ello, en 1957, recibió el premio Átomos para la Paz, convocado por la Fundación Ford para favorecer las investigaciones científicas encaminadas al progreso de la humanidad.

Niels Bohr en una imagen tomada en 1950
Director, desde 1953, de la Organización Europea para la Investigación Nuclear, Niels Henrik David Bohr falleció en Copenhague durante el otoño de 1962, a los setenta y siete años de edad, después de haber dejado impresas algunas obras tan valiosas como Teoría de los espectros y constitución atómica (1922), Luz y vida (1933), Teoría atómica y descripción de la naturaleza (1934), El mecanismo de la fisión nuclear (1939) y Física atómica y conocimiento humano (1958).
El modelo atómico de Bohr
Las primeras aportaciones relevantes de Bohr a la Física contemporánea tuvieron lugar en 1913, cuando, para afrontar los problemas con que había topado su maestro y amigo Rutherford, afirmó que los movimientos internos que tienen lugar en el átomo están regidos por leyes particulares, ajenas a las de la física tradicional. Al hilo de esta afirmación, Bohr observó también que los electrones, cuando se hallan en ciertos estados estacionarios, dejan de irradiar energía.
En realidad, Rutherford había vislumbrado un átomo de hidrógeno conformado por un protón (es decir, una carga positiva central) y un partícula negativa que giraría alrededor de dicho protón de un modo semejante al desplazamiento descrito por los planetas en sus órbitas en torno al sol. Pero esta teoría contravenía las leyes de la física tradicional, puesto que, a tenor de lo conocido hasta entonces, una carga eléctrica en movimiento tenía que irradiar energía, y, por lo tanto, el átomo no podría ser estable.
Niels Bohr aceptó, en parte, la teoría atómica de Rutherford, pero la superó combinándolo con las teorías cuánticas de Max Planck (1858-1947). En los tres artículos que publicó en el Philosophical Magazine en 1913, Bohr enunció cuatro postulados: 1) Un átomo posee un determinado número de órbitas estacionarias, en las cuales los electrones no radian ni absorben energía, aunque estén en movimiento. 2) El electrón gira alrededor de su núcleo de tal forma que la fuerza centrífuga sirve para equilibrar con exactitud la atracción electrostática de las cargas opuestas. 3) El momento angular del electrón en un estado estacionario es un múltiplo de h / 2p (donde h es la constante cuántica universal de Planck).
Según el cuarto postulado, cuando un electrón pasa de un estado estacionario de más energía a otro de menos (y, por ende, más cercano al núcleo), la variación de energía se emite en forma de un cuanto de radiación electromagnética (es decir, un fotón). Y, a la inversa, un electrón sólo interacciona con un fotón cuya energía le permita pasar de un estado estacionario a otro de mayor energía.

Werner Heisenberg y Niels Bohr en
la Conferencia de Copenhague (1934)
Dicho de otro modo, la radiación o absorción de energía sólo tiene lugar cuando un electrón pasa de una órbita de mayor (o menor) energía a otra de menor (o mayor), que se encuentra más cercana (o alejada) respecto al núcleo. La frecuencia f de la radiación emitida o absorbida viene determinada por la relación: E1 - E2 = hf, donde E1 y E2 son las energías correspondientes a las órbitas de tránsito del electrón. Merced a este último y más complejo postulado, Bohr pudo explicar por qué, por ejemplo, los átomos de hidrógeno ceden distintivas longitudes de onda de luz, que aparecen en el espectro del hidrógeno como una distribución fija de líneas de luz conocida como serie de Balmer.
En un principio, el modelo atómico propuesto por Bohr desconcertó a la mayor parte de los científicos de todo el mundo. Su manera de explicar la estructura de un átomo era hacer caso omiso (al menos en ciertas partes pequeñas del átomo) de un principio aceptado de la física. La teoría atómica de Bohr parecía casi un timo: inventar un modelo simplemente por el hecho de que podría funcionar bien. Pero, a raíz de que su colega y maestro Rutherford le felicitara efusivamente por estos postulados, numerosos investigadores del Centro y el Norte de Europa comenzaron a interesarse por las ideas del físico danés, y algunos de ellos, como los alemanes James Franck (1882-1964) y Gustav Hertz (1887-1975), proporcionaron nuevos datos que confirmaban la validez del modelo de Bohr.
La teoría atómica de Bohr se aplicó, en efecto, al estudio del átomo de hidrógeno, aunque enseguida pudo generalizarse a otros elementos superiores, gracias a la amplitud y el desarrollo que le proporcionó el trabajo de Arnold Sommerfeld (1868-1951), que mejoró el modelo del danés para explicar la estructura fina del espectro. De ahí que los postulados lanzados por Niels Bohr en 1913 puedan considerarse como las bases en que se sustenta la física nuclear contemporánea.
El principio de correspondencia
Con la formulación de estos postulados, Niels Bohr logró, en efecto, dar una explicación cuantitativa del espectro del hidrógeno; y, fundamentalmente, consiguió establecer los principios de la teoría cuántica del átomo en la forma más clara y concisa posible. Pero, ante todo, su gran acierto fue señalar que estos principios eran irracionales desde el punto de vista de la mecánica clásica, y advertir que requerían una nueva limitación en el uso de los conceptos ordinarios de causalidad.
Para fijar las circunstancias en que debían concordar la mecánica clásica y las nuevas teorías de la mecánica cuántica, Bohr estableció en 1923 el denominado principio de correspondencia, en virtud del cual la mecánica cuántica debe tender hacia la teoría de la física tradicional al ocuparse de los fenómenos macroscópicos (o, dicho de otro modo, siempre que los valores de las constantes cuánticas lleguen a ser despreciables).
Sirviéndose de este principio, Niels Bohr y sus colaboradores, entre los que se contaba el joven Werner Karl Heisenberg (1901-1976), otro futuro Premio Nobel de Física, trazaron un cuadro aproximado de la estructura de los átomos que poseen numerosos electrones; y consiguieron otros logros como explicar la naturaleza de los rayos X, los fenómenos de la absorción y emisión de luz por parte de los átomos y la variación periódica en el comportamiento químico que reflejaba la tabla periódica de los elementos.
El principio de complementariedad
En 1925, su ayudante Heisenberg enunció el principio de indeterminación o de incertidumbre, según el cual era utópica la idea de poder alcanzar, en el campo de la microfísica, un conocimiento pleno de la realidad de la naturaleza en sí misma o de alguna de las cosas que la componen, ya que los instrumentos empleados en la experimentación son objetos naturales sometidos a las leyes de la física tradicional.
La formulación de este luminoso principio de Werner Heisenberg sugirió a su vez a Bohr un nuevo precepto: el llamado principio de complementariedad de la mecánica cuántica (1928). Partiendo de la dualidad onda-partícula recientemente enunciada por el joven Louis de Broglie (1892-1987), es decir, de la constatación de que la luz y los electrones actúan unas veces como ondas y otras como partículas, Bohr afirmó que, en ambos casos, ni las propiedades de la luz ni las de los electrones pueden observarse simultáneamente, por más que sean complementarias entre sí y necesarias para una interpretación correcta.
En otras palabras, el principio de complementariedad expresa que no existe una separación rígida entre los objetos atómicos y los instrumentos que miden su comportamiento. Ambos son, en opinión de Bohr, complementarios: elementos de diversas categorías, incluyendo fenómenos pertenecientes a un mismo sistema atómico, pero sólo reconocibles en situaciones experimentales que son físicamente incompatibles.
Siguiendo este razonamiento, Niels Bohr también consideró que eran complementarias ciertas descripciones, generalmente causales y espacio-temporales, así como ciertas propiedades físicas como la posición y el momento precisos. En su valioso ensayo titulado Luz y vida (1933), el científico danés, dando una buena muestra de sus singulares dotes para la especulación filosófica, analizó las implicaciones humanas del principio de complementariedad.
La fisión nuclear
En la década de los años treinta, el creciente interés de todos los científicos occidentales por el estudio del interior del núcleo del átomo (con abundante experimentación al respecto) llevó a Bohr al estudio detallado de los problemas surgidos al tratar de interpretar los nuevos conocimientos adquiridos de forma tan repentina por la física atómica. Fue así como concibió su propio modelo de núcleo, al que comparó con una gota líquida, y propuso la teoría de los fenómenos de desintegración nuclear.
Con ello estaba sentando las bases de la fisión nuclear, que acabaría dando lugar al más poderoso instrumento de exterminio concebido hasta entonces por el ser humano: la bomba atómica. Bohr no llegó, empero, en primer lugar al hallazgo de la fisión nuclear, conseguida por vez primera, como ya se ha indicado más arriba, por Otto Hahn y Fritz Strassmann en el Berlín de 1938.
El 15 de enero de 1939 llevó las primeras nuevas de este logro científico a los Estados Unidos de América, en donde demostró que el isótopo 235 del uranio es el responsable de la mayor parte de las fisiones. En el Instituto de Estudios Avanzados de Princeton (Nueva Jersey), durante un fructífero período de colaboración con J. A. Wheeler, esbozó una nueva teoría del mecanismo de fisión, según la cual el elemento 94 tendría idéntico comportamiento al observado en el U-235 en el proceso de fisión nuclear. El elemento 94 sería obtenido un año después por Glenn Theodore Seaborg (1912-1999) y recibió el nombre de plutonio por hallarse a continuación del uranio y del neptunio en la tabla periódica
--------------
Walter Bothe
(Walter o Walther Bothe; Oranienburg, 1891 - Heidelberg, 1957) Físico alemán que en 1954 obtuvo el Premio Nobel de Física (compartido con el británico Max Born) por sus investigaciones en el desarrollo de la espectroscopia de coincidencia y su aplicación en el estudio de los rayos cósmicos y otras radiaciones penetrantes.

Walter Bothe
Desde 1908 hasta 1912 estudió física, matemáticas, química y música en la Universidad de Berlín. De 1912 a 1914 realizó su tesis doctoral (sobre un modelo teórico de la difracción y reflexión de la luz por átomos individuales) tutelado por Max Planck, quien lo consideraba entre sus mejores alumnos y con quien conservó una duradera amistad. En 1913 comenzó a trabajar en el Physikalisch-Technische Reichsanstalt de Berlín como asistente de Hans Geiger,
Hans Geiger
(Neustadt, Alemania, 1882 - Potsdam, id., 1945) Físico alemán, inventor del contador para detectar y medir la presencia de partículas radioactivas que lleva su nombre. Se doctoró en 1906 por la Universidad de Erlangen. Entre 1907 y 1912 colaboró con Ernest Rutherford en la Universidad de Manchester. En 1912, ya en Alemania, ocupó el puesto de director del Laboratorio de Física Alemán y en 1925 el de profesor en la Universidad de Kiel.

Hans Geiger
Durante su estancia en el Reino Unido construyó la primera versión del detector y contador de partículas que lleva su nombre, indispensable en la identificación de la naturaleza de las partículas alfa como núcleos de helio efectuada por Rutherford y él mismo. El primer contador Geiger estaba formado por un cilindro lleno de gas a presión reducida y un alambre aislado a través de su eje, estableciéndose entre ambos una alta diferencia de potencial. El paso de una partícula a través del contador produce una descarga corta, que es aumentada por la ionización secundaria que se produce en virtud de las colisiones; estas descargas se registraban mecánicamente.
Eligiendo de modo adecuado la naturaleza y el espesor de la pared del tubo, puede prepararse el dispositivo para el recuento de partículas de un cierto tipo. Para contar electrones procedentes de radiaciones cósmicas la pared es de un metal muy delgado, capaz de ser atravesado por ellos; para los protones el tubo ha de poseer una ventana recubierta de una delgadísima hoja metálica; y, para los fotones de una radiación, la pared ha de ser de plomo y muy espesa. Ya en 1928 (en colaboración con W. Müller, quien le incorporó un amplificador), Geiger perfeccionó su invento haciéndolo capaz de detectar partículas beta (electrones) y fotones electromagnéticos ionizados. Posteriormente estudió la naturaleza de los rayos cósmicos y contribuyó a la identificación de los isótopos del polonio (elemento número 84 de la tabla periódica), el primero de los elementos radiactivos descubiertos por Pierre y Marie Curie.
Cómo citar este artículo:
que acababa de regresar de Inglaterra y quien tuvo una notable influencia sobre Bothe. Allí conoció a Einstein, Otto Hahn,
Otto Hahn
(Frankfurt, Alemania, 1879 - Gotinga, id., 1968) Químico alemán, descubridor de la fisión nuclear. Estudió química en la Universidad de Marburgo, en la que se doctoró en 1901. Tres años más tarde se trasladó a Londres, donde colaboró con sir William Ramsay en investigaciones relacionadas con la radiactividad, descrita pocos años antes por Pierre y Marie Curie. Ya en esta época, al intentar purificar una muestra de radio, identificó la presencia de una nueva sustancia radiactiva a la que denominó radiotorio. Animado por este descubrimiento, viajó hasta Montreal (donde trabó amistad con Ernest Rutherford) para ampliar sus conocimientos sobre los fenómenos radiactivos.

Otto Hahn
A su regreso a Alemania, en 1906, trabajó con la física austriaca Lise Meitner, con la que se trasladó al nuevo Instituto Químico Káiser Guillermo de Berlín, cinco años más tarde, para dirigir el departamento de radioquímica. Tras la Primera Guerra Mundial, Hahn y Meitner estuvieron entre los primeros en aislar el isótopo 231 del protactinio (elemento número 91 de la tabla periódica), uno de los últimos elementos radiactivos naturales descubiertos.
En 1934, el físico italoestadounidense Enrico Fermi
Enrico Fermi
(Roma, 1901 - Chicago, 1954) Físico nuclear italiano. Fue alumno de la Escuela Normal Superior de Pisa y se graduó en 1922. Entre este año y 1932 se desarrolló la primera fase de su actividad científica: la de la física atómica y molecular. En 1927 aplicó la "estadística de Fermi" a los electrones que se mueven en torno al núcleo del átomo, con lo cual estableció un método aproximativo para el estudio de muchas cuestiones atómicas ("método de Thomas-Fermi").

Enrico Fermi
El segundo período de su labor en el ámbito de la ciencia se extendió entre 1933 y 1949, y estuvo dedicado a la física nuclear. En 1933 su teoría de la radiactividad "beta" dio forma cuantitativa al proceso de la transformación de un neutrón en un protón mediante la emisión de un electrón y un neutrino. Luego estudió la radiactividad artificial, descubierta por Frédéric Joliot e Irène Curie (hija de Marie Curie), y en 1934 descubrió la provocada por un bombardeo de neutrones; posteriormente vio que las sustancias hidrogenadas y en general los elementos ligeros podían disminuir la velocidad de los neutrones después de choques elásticos. Y así, en 1935-36 estudió las propiedades de absorción y difusión de los neutrones lentos.
Todo ello le valió en 1938 el premio Nobel de Física. A fines de aquel año se trasladó a los Estados Unidos; allí trabajó en la Columbia University de Nueva York, y luego, a partir de 1942, en la Universidad de Chicago, donde, tras las investigaciones llevadas a cabo con diversos colaboradores, hizo funcionar el 2 de diciembre de 1942 una pila de uranio y grafito, el primer reactor nuclear.
Terminada la guerra, se dedicó al estudio de los neutrones lentos y, en particular, de la difracción de los neutrones por diversos cristales. Durante el período 1947-49 realizó investigaciones teóricas y experimentales sobre las influencias mutuas existentes entre las partículas elementales y publicó un esbozo de teoría acerca del origen de los rayos cósmicos. La última fase de la actividad científica de Enrico Fermi empezó en 1949, comprendiendo una amplia serie de experiencias sobre las propiedades de difusión de los mesones por los protones, campo en el cual llegó asimismo a numerosos resultados fundamentales.
Además de unas doscientas memorias aparecidas en varias revistas de Italia y de otras naciones, publicó cuatro libros: Introduzione alla Fisica atomica (1928), Molecole e cristalli (1934), Thermodynamics (1937) y Elementary particles (1951). En 1953 fue nombrado presidente de la American Physical Society. Perteneció a muchas academias italianas y extranjeras, y fue galardonado en diversos países; una partícula subatómica, el fermión, y el elemento número 100 de la tabla periódica, el fermio, recibieron su nombre en su honor. La figura de Enrico Fermi destaca en la historia de la física no sólo por sus dotes de investigador, sino también por sus elevadas cualidades de maestro.
Cómo citar este artículo:
observó que, tras bombardear con neutrones el uranio, proceso en el que se libera una ingente cantidad de energía, se forman una serie de productos radiactivos. A finales de 1938, Hahn, en colaboración con el joven Fritz Strassman, pues Meitner se vio obligada a huir de Alemania a causa de la persecución nazi contra los judíos, concluyó, en contra de las expectativas iniciales, que uno de los productos de la desintegración del uranio es un isótopo radiactivo de un elemento de mucho menor peso, el bario, lo cual indujo a pensar que el átomo de uranio se divide en dos átomos más ligeros tras el proceso de bombardeo con neutrones.
El fenómeno, que fue bautizado con el nombre de fisión nuclear, le supuso a su descubridor el Premio Nobel de Química de 1944. Después de haber abandonado Alemania durante los años de la Segunda Guerra Mundial para instalarse en el Reino Unido, regresó a su país convertido en una figura de relieve social, comprometido con la causa vinculada al desarme nuclear.
-----
Fritz Strassmann
(Boppaard, 1902 - Maguncia, 1980) Físico y químico alemán que descubrió la fisión del uranio, junto con Otto Hahn. Estudió en el Instituto Tecnológico de Hannover y fue profesor de química-física en dicha institución. Tras la Segunda Guerra Mundial fue director del Instituto de Química Inorgánica y Nuclear de Maguncia, y en 1953 entró a formar parte del cuerpo docente e investigador del prestigioso Instituto Max Planck, donde más tarde sería elegido director del departamento de química. Sus investigaciones le valieron en 1966 el Premio Enrico Fermi, compartido con Otto Hahn y Lise Meitner.

Fritz Strassmann
La fisión nuclear es el proceso de ruptura del núcleo de un átomo pesado en dos o más núcleos de menor tamaño. El descubrimiento de la reacción de fisión se produjo de forma casual en 1939. Strassmann y el también físico alemán Otto Hahn habían emprendido una serie de experimentos consistentes en bombardear diversos elementos con neutrones. Al bombardear cobre, por ejemplo, se producía una forma radiactiva del cobre, y lo mismo sucedía al bombardear otros elementos.
Con el uranio, sin embargo, los resultados obtenidos fueron completamente diferentes; de hecho, se apartaban tanto de lo esperado que Strassmann y Hahn fueron incapaces de ofrecer una explicación satisfactoria de ellos. En la mayoría de las reacciones nucleares, los átomos pasan de una forma estable a una forma radiactiva, o se transforman en átomos algo más pesados o algo más ligeros. Por ejemplo, el cobre (elemento número 29 en la tabla periódica de los elementos) puede pasar de una forma estable a una forma radiactiva, o transformarse en cinc (elemento número 30) o en níquel (elemento número 28). Estas reacciones eran ya bien conocidas por entonces en el campo de la investigación nuclear.
Lo que Strassmann y Hahn observaron, sin acertar a identificar, fue una transformación nuclear mucho más importante: la escisión de un átomo de uranio (elemento número 92), al ser bombardeado por un neutrón, en dos elementos de número atómico muy inferior, como son el criptón (elemento número 36) y el bario (elemento número 56). La reacción recibió el nombre de fisión en analogía con el proceso de fisión celular por el que una célula se divide en dos. El fenómeno sería explicado por la física alemana Lise Meitner y su sobrino Otto Frisch. Meitner había sido, durante largo tiempo, colaboradora de Hahn, hasta que fue obligada a abandonar Alemania a causa de la persecución antisemita.
La escisión de los núcleos de uranio en dos núcleos más pequeños iba acompañada de la emisión de grandes cantidades de energía. Muchos investigadores advirtieron inmediatamente las posibilidades que la reacción de fisión nuclear ponía a disposición del hombre, tanto en su reverso positivo como negativo; su descubrimiento fue el inicio de una carrera para la fabricación de bombas y de otros tipos de armamento, así como para la producción de energía en tiempo de paz.
Lise Meitner y Erwin Schrödinger.
El trabajo con Geiger se interrumpió bruscamente al estallar la Primera Guerra Mundial. Destinado en las campañas del frente ruso, Walter Bothe fue capturado y enviado a un campo de prisioneros en Siberia durante cinco años. Para hacer más llevadero su aislamiento siberiano, aprendió ruso, calculó su propia tabla de logaritmos y trabajó sobre el desarrollo matemático de su tesis doctoral.
En 1920 fue liberado y regresó a Alemania casado con la moscovita Barbara Below. Walter Bothe se incorporó a su trabajo en el Physikalisch-Technische Reichsanstalt, donde desarrolló el método de coincidencia de análisis de radicación gamma que fue publicado conjuntamente con Geiger en 1924. Este método se basa en una disposición de múltiples contadores geiger próximos entre sí. Cualquier partícula de alta energía que atraviese el conjunto dejará un rastro de pulsos en los diferentes contadores que coincidirán en el tiempo y que determinan la trayectoria de la partícula o fotón. Gracias al método de coincidencia se pudieron analizar y diferenciar los productos múltiples de desintegración de átomos.
Desde 1923 hasta 1926 se concentró en el estudio teórico y experimental acerca de la naturaleza corpuscular de la luz. Iluminando con rayos X una cámara de Wilson llena de hidrógeno, observó las trayectorias de los electrones de retroceso (recoil) producidos por los fotones de rayos X, lo que más tarde se conocería como Efecto Compton. Bothe aplicó su método de coincidencia, pero desafortunadamente no fue él quien interpretó correctamente el fenómeno, sino Arthur Compton, acierto que le valió ser premiado con el Nobel.
En 1927, en colaboración con H. Becker, comenzó el estudio de las transformaciones por bombardeo de elementos ligeros con partículas alfa provenientes del polonio. En 1930, cuando ya ocupaba el cargo de profesor de física y director del Instituto de Física de la Universidad de Giessen, bombardeó berilio con partículas alfa y obtuvo una radiación mucho más penetrante que las conocidas hasta entonces, capaz de atravesar fácilmente el plomo. Bothe pensó que se trataba de un nuevo tipo de radiación gamma, pero, no satisfecho, pidió ayuda a Irene Joliot-Curie, hija de la célebre Marie Curie. Tampoco entonces acertó con la naturaleza exacta de esta radiación (neutrones), que sí logró James Chadwick en 1932.
A partir de 1929, y en colaboración con W. Kolhörster y el italiano Bernardo Rosi, Bothe comenzó a estudiar la radiación cósmica y ultravioleta empleando el método de coincidencia. Para ello realizó mediciones en diferentes lugares del mundo, llegando a la conclusión de que esta radiación procedía siempre del espacio profundo y no era radiación gamma como se pensaba con anterioridad, sino partículas de gran energía que hoy conocemos como mesones.
En 1932 fue nombrado director del Instituto de Física de la Universidad de Heidelberg en sucesión de Philipp Lenard, que se había jubilado. Duró poco en este puesto, ya que no congeniaba ni con las teorías clásicas que defendía la universidad ni con el antisemitismo que reinaba en la misma y que se agravó con la subida de Hitler al poder en 1933. Renunció al puesto en 1934 y aceptó el de director de física del que hoy se llama Instituto Max Planck (MPI) para la Investigación Medica de la misma ciudad. El laboratorio contaba con pocos recursos y materiales, pero a cambio estaba libre de la influencia política de la universidad y gozaba de absoluta libertad de investigación. Allí, en 1936 y en colaboración con Wolfgang Gentner, construyó un generador Van der Graaff (el primero en Europa) para la experimentación con núcleos de átomos de peso medio.
En junio de 1939 fue llamado a Berlín para participar en el Uranverein (Club del Uranio), grupo de científicos creado con el propósito de investigar las aplicaciones militares de la fisión atómica. Durante el periodo 1939-1945, consiguió con grandes dificultades el dinero para construir un ciclotrón, trabajó sobre la difusión y detección de neutrones, y publicó su Atlas de Imágenes con Cámara de Niebla.
Al terminar la Segunda Guerra Mundial, los aliados suspendieron todas la investigaciones en física nuclear y el mismo Bothe fue investigado sobre su posible colaboración con el nazismo. A pesar de que los americanos emplearon todos los medios para despojar a Alemania de científicos y llevárselos a América, Bothe persistió en reconstruir el MPI. En esa época fue nombrado de nuevo director del Departamento de Física de la Universidad de Heidelberg, cargo que compaginó con su trabajo en el MPI hasta su muerte.
Fue miembro de las academias de ciencias de Heidelberg, Göttingen, y Sajonia; obtuvo la Medalla Max Planck y la Gran Cruz de la Orden de Servicios Federales; en 1952 fue nombrado Caballero de la Orden del Mérito de las Ciencias y de las Artes; y en 1954 recibió el Premio Nobel de Física (compartido con Max Born). Estaba considerado como un profesor íntegro, duro y exigente, sin ningún dogmatismo y con capacidad para valorar con justeza tanto cualquier idea nueva como los méritos de sus colaboradores. Sin embargo, en el trato personal era célebre por su gran hospitalidad, al igual que su esposa Barbara Below, con quien tuvo dos hijos.
Las virtudes de Bothe no estuvieron únicamente aplicadas a la física. Poseía una gran capacidad de concentración y el hábito de hacer de su tiempo el mejor uso posible, lo cual le confirió una gran capacidad y velocidad de trabajo. Siempre se consideró un patriota alemán y colaboró con la industria armamentística alemana con todo su entusiasmo, algo por lo que nunca se excusó. No obstante, debido a su integridad tuvo frecuentes problemas con el Partido Nazi y con la Gestapo. Era aficionado a la musica clásica y asistía muy a menudo a conciertos de Bach y Beethoven. También tocaba el piano y pintaba (generalmente paisajes de corte impresionista) con la misma pasión y esfuerzo que realizaba su trabajo en el laboratorio.











No hay comentarios:
Publicar un comentario
Comentate algo, no seas amarrrrgo... y si comentás, no nos amargués :D